|
||||||||||
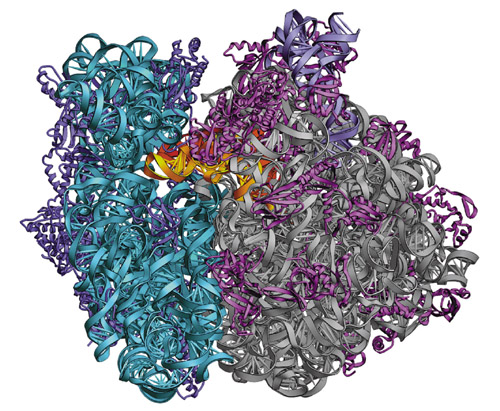
Нобелевский комитет присудил премию по химии за 2009 год трем ученым: Венкатраману Рамакришнан (Venkatraman Ramakrishnan), Великобритания, Томасу Стейцу (Thomas Steitz), США и Аде Йонат (Ada Yonath), Израиль. Премия присуждена с формулировкой: «За исследования структуры и функций рибосомы», клеточных органелл, отвечающих за производство белков в живых организмах. Однако выбор награжденных явно свидетельствует, что определяющим фактором явилось при этом установление лауреатами трехмерной структуры рибосомы с высоким разрешением, что позволило сделать целый ряд определенных выводов о некоторых этапах сложного процесса синтеза белка в рибосоме. Размеры рибосомы, универсальной фабрики по производству белков, представляющей собой сложнейший комплекс рибосомных белков и рибосомных РНК (рибонуклеиновых кислот), несопоставимы со всеми молекулами и комплексами, структуры которых были получены до сих пор методом рентгенографии. Положение сотен тысяч атомов расставлено в пространстве с точностью 2.5-5 ангстрем. Эти данные в интернете доступны каждому ученому, потрясающе красивые структуры позволяют целенаправленно планировать новые эксперименты. Выполнена фантастически сложная работа, которая имеет не только огромное фундаментальное, но и большое практическое значение уже сегодня. Генетическая информация в живых системах хранится и передается по наследству в виде последовательности нуклеотидов в их ДНК (дезоксирибонуклеиновой кислоте). Большая часть этих последовательностей кодирует белки, которые выполняют большинство функций во всех организмах. Сначала информация с ДНК переписывается на иРНК (информационную рибонуклеиновую кислоту), которая затем связывается с рибосомами, где она прочитывается и переводится в различные последовательности аминокислот всех белков организма. Бактериальная (70S ) рибосома состоит из малой (30S ) и большой (50S ) субъединиц с молекулярными весами около 800 000 и 1 500 000 Дальтон, соответственно. Малая субъединица состоит из различных белков, число которых 21 и рибосомной РНК 16S, содержащей около 1 600 нуклеотидов. Большая субъединица состоит из 33-х разных белков и рибосомной РНК 23S с последователностью около 2 900 нуклеотидов и рибосомной РНК 5S из 120-ти нуклеотидов. Работа рибосомы по синтезу белковой молекулы состоит в том, что надо с высокой точностью соединить пептидной связью от десятков до нескольких тысяч аминокислот (в полипептидных цепях разных белков) двадцати сортов (глицин, аланин,фенилаланин, лизин, метионин, и т.д.) в определенной последовательности. Эта последовательность для каждого белка уникальна и закодирована в информационной РНК (иРНК) в виде последовательности нуклеотидов с одним из четырех разных оснований (аденин – А, гуанин-Г, урацил-У, цитозин-Ц) с использованием трехбуквенного кода. Одна или несколько комбинаций из трех нуклеотидов (триплет, кодон) кодируют определенную аминокислоту. Так, например, триплеты УУУ или УУЦ кодируют аминокислоту фенилаланин, кодон ААА кодирует лизин, кодон АУГ кодирует метионин и дает команду для начала синтеза и т.д. На многоэтапном пути от ДНК к готовому белку клетка использует более полутора сотен других белков, катализирующих необходимые для этого реакции. Даже в финальном процессе в самой рибосоме участвуют еще около 15 белковых факторов и еще один тип РНК, так называемая транспортная РНК (тРНК), которая доставляет очередную аминокислоту в рибосому и при этом выполняет роль переводчика с языка нуклеотидов в РНК на язык аминокислот в белке. В своей структуре молекулы тРНК имеют три нуклеотида (антикодон), комплементарных одному из кодонов иРНК. Благодаря кодон-антикодоновому взаимодействию тРНК и иРНК образуют стабильный комплекс в рибосоме. К другому концу тРНК присоединена аминокислота, которая закодирована этим триплетом, и таким образом тРНК при связывании помещает аминокислоту в синтезирующий центр рибосомы (пептидилтрансферазный центр – ПТЦ). В процессе удлинения (элонгации) полипептидной цепи белка в рибосоме задействованы три сайта, через которые тРНК перемещаются в процессе синтеза. На Р сайте находится пептидил-тРНК (растущий полипептид синтезируемого белка, связанный с тРНК, доставившей предыдущую аминокислоту). На А сайте происходит связывание очередной аминоацил-тРНК (аа-тРНК, т.е.тРНК с присоединенной аминокислотой и в комплексе с фактором элонгации и ГТФ) в соответствии со следующим кодоном в иРНК. Рибосома катализирует перенос пептидильного остатка от пептидил-тРНК на аа-тРНК, и в результате, выросшая на один аминокислотный остаток пептидил-тРНК, оказывается связанной с А сайтом, а на Р сайте остается пустая тРНК (без аминокислоты). Чтобы повторить процесс элонгации и присоединить следующую аминокислоту к пептиду, необходимо продвинуть иРНК на один триплет, освободить Р сайт, переместив пустую тРНК в выходной сайт Е, и перенести пептидил-тРНК из А сайта в Р сайт. Этот процесс называется транслокацией и происходит при участии дополнительного фактора элонгации и ГТФ. Не менее сложно (и с участием также ряда специальных белковых факторов) происходит и организация процессов начала синтеза (образование первой пептидной связи) и окончания и выхода синтезированного белка из рибосомы.
В составление сегодняшней схемы процесса синтеза в рибосоме вложен труд по меньшей мере сотен коллективов ученых в разных странах в течение 50 лет. Многие этапы этого пути уже отмечены Нобелевскими премиями: определение последовательности нуклеотидов (76 нуклеотидов) первой тРНК (а всего их более 50), расшифровка генетического кода (1968г.), определение последовательности нуклеотидов (120 нуклеотидов) в рибосомной 5S РНК (1980г.), пространственная структура фенилаланиновой тРНК (1982г.), открытие каталитических свойств РНК, рибозим (1989г.). Существенный вклад в составление принятой теперь схемы синтеза белка внесли и исследования ученых отдела молекулярной и радиационной биофизики ПИЯФ РАН, начатые в 60-е годы. И первый вклад в классическую схему: существование такого соединения как пептидил-тРНК при синтезе белка в натуральной системе, был сделан в 1966 г. (кандидатская диссертация автора). Работы по исследованию механизмов биосинтеза белка во всем мире ведутся на выделенных из живых клеток рибосомах, которые в виду их чрезвычайной сложности повреждаются при выделении. Только 5-10% выделенных рибосом обычно было активно в связывании тРНК и синтезе белка. Мы поставили себе задачу изучить количественно термодинамику и кинетику взаимодействия тРНК и иРНК с рибосомами. Ведь фактически, весь процесс синтеза состоит из последовательности таких взаимодействий. Для этого необходимы были активные рибосомы, и мы научились это делать. К концу 70-х годов все рибосомы в наших препаратах были активны во всех традиционных тестах (Ю.П.Семенков и В.И. Махно) и связывали по три молекулы тРНК (Е.М.Саминский с сотр.). Тем самым было доказано наличие третьего – выходного сайта Е в рибосомах. Была изучена термодинамика взаимодействия всех функциональных форм тРНК с субъединицами и целой рибосомой и определен вклад субъединиц в формирование сайтов связывания тРНК, доказано (и измерено) наличие кодон-антикодонового взаимодействия тРНК на Р сайте и отсутствие такового на Е сайте. Все это признано и вошло в классические схемы синтеза в рибосоме. В последние 15 лет акцент в исследовании механизмов синтеза в рибосоме переместился на кинетические исследования отдельных этапов. Синтез белка в клетке идет с высокой скоростью (10 пептидных связей в секунду). Изучать такие быстрые процессы можно только с применением специальной техники «остановленного потока», которая отсутствовала в нашей стране и не по карману нам и сейчас из-за отсутствия должного финансирования науки у нас. Такие исследования мы смогли проводить только в зарубежных лабораториях (Германия, США). Долговременное сотрудничество было установлено с частным Университетом Виттена-Хердеке (Германия). Нам повезло, что в лаборатории биосинтеза белка ОМРБ (под руководством к.б.н. Семенкова Ю.П.) начала свою карьеру в 80-е годы и выполнила кандидатскую диссертацию Марина Роднина, которая затем получила стипендию фонда Гумбольдта в Германии и выполнила целый ряд кинетических исследований процессов в рибосомах. Кинетические схемы основных этапов синтеза, разработанные в ее лаборатории с участием наших сотрудников (Ю.П.Семенков, В.И.Катунин) стали уже теперь классическими. Автор этой заметки 4 года использовал оборудование для кинетических исследований в Пеннсильванском университете (США). Была установлена определяющая роль взаимодействия центральной части молекулы тРНК с рибосомой в обеспечении ее движения, и открыт новый этап в процессе транслокации, что явилось существенным дополнением классической схемы транслокации. Высокий уровень и признание этих работ научной общественностью подтверждается тем, что профессор М.Роднина назначена в этом году пожизненным директором Института биофизической химии Макса Планка и избрана немецким академиком. По значимости функциональных работ М.Роднина могла бы вполне претендовать на Нобелевскую премию. К концу 20-го столетия были уже расшифрованы все первичные структуры рибосомных и транспортных РНК, пространственные структуры практически всех рибосомных белков, созданы компьютерные модели структуры рибосомы и описаны основные этапы синтеза. Однако оставалось множество нерешенных вопросов по механизму и природе катализа, транслокации, процесса повышения точности трансляции самой рибосомой. Часто не хватало определяющих данных для выбора из нескольких возможных механизмов основных этапов. Естественно, что получение структуры рибосомы на атомарном уровне должно было дать ответы на многие, если не все, вопросы. Но первые кристаллы рибосом, полученные в 80-е годы, были настолько несовершенны, что внушили большинству рибосомологов (в том числе и автору этих строк) уверенность в невозможности получения методом рентгенографии структуры с высоким разрешением, необходимым, чтобы сделать какие-либо существенные выводы о механизме синтеза в рибосоме. И все же, казалось бы, невозможное произошло в конце прошлого столетия. Этим мы обязаны в первую очередь Аде Йонат. Она объединила всех европейских энтузиастов кристаллографии и развивала и совершенствовала методики кристаллографии в течение 25 лет. Она первой применила методику низкотемпературной кристаллизации белков для рибосом, что сдвинуло проблему с мертвой точки. Только тогда, когда стало ясно, что проблема решаема, фармацевтические фирмы предоставили практически неограниченное финансирование, и в соревнование вступили три группы американских кристаллографов. В результате, к 2000-му году были получены даже немного раньше группы А.Йонат первые структуры большой (Т.Стейц) и малой субъединиц (В.Рамакришнан), и целой рибосомы 70S (Г.Ноллер, В.Рамакришнан) с атомарным разрешением. Так четыре группы исследователей оказались в числе претендентов на три вакансии лауреатов. В течение последующих 8-ми лет шло соревнование этих 4-х групп в получении структур функционально активных комплексов рибосом, включая комплексы с антибиотиками. Большинство применяемых в медицине антибиотиков работает в рибосоме, блокируя разные этапы синтеза белка, что и останавливает развитие инфекции патогенными микроорганизмами. Установление молекулярной структуры комплексов рибосомы с антибиотиками привело к пониманию механизмов ингибирования и дало мощный импульс к созданию новых эффективных лекарственных форм. Здесь наибольший вклад сделан группами А.Йонат и В.Рамакришнан. А по завещанию А.Нобеля премии должны присуждаться в первую очередь за научные открытия, нашедшие широкое практическое применение. Группа Т.Стейца из Йельского университета, получившая структуру большой субъединицы рибосом, в которой находится синтезирующий центр, ответила на самый интригующий вопрос: кто осуществляет катализ образования пептидной связи? Белок или РНК? В синтезирующем центре рибосомы не было найдено ни одной белковой группы ближе 18 Ангстрем, только рибосомная РНК. И значит, РНК большой субъединицы рибосом катализирует синтез пептидной связи, является рибозимом. В течение длительного периода времени все думали, что один из рибосомных белков осуществляет катализ, и пытались безуспешно его идентифицировать. Однако в последние десятилетия было установлено множеством независимых методов, что именно рибосомная РНК не только задает структуру рибосомы, но и определяет большинство функций в рибосоме, а белки выполняют вспомогательную роль. Здесь группа Г.Ноллера занимает ведущие позиции. По сумме всех данных был составлен пептидилтрансферазный центр, состоящий из одних нуклеотидов. После открытия каталитических свойств у РНК (Нобелевская премия 1989 г.) стало ясно, что первоначально мир был РНКовым, а белок появился позже. Примечательно, что один из первых двух открытых рибозимов был предшественник рибосомной РНК, который сам у себя отрезал фрагмент длиной около 400 нуклеотидов и превращался в зрелую рибосомную РНК большой субъединицы рибосом. Но это не означало еще, что рибосомная РНК осуществляет и катализ образования пептидной связи без участия белка. Ведь оба первых рибозима производили действия над РНК, будучи сами рибонуклеиновыми кислотами. В рибосоме ситуация много сложнее. Нужны были прямые доказательства, что чистая рибосомная РНК способна осуществлять катализ образования пептидной связи. И такие попытки предпринимались несколько раз, в том числе и группой Г.Ноллера, но каждый раз оказывалось, что были допущены ошибки, присутствие белка не было исключено полностью. Это обстоятельство, видимо, и определило выбор третьего лауреата. Установление структуры рибосомы уже ответило на целый ряд принципиально важных вопросов механизма биосинтеза белка и в будущем, несомненно, ускорит получение ответов на еще нерешенные вопросы, которых достаточно много. Но синтез белка не единственная функция рибосомы (хотя и главная). Рибосома находится в центре многих регуляторных процессов в клетке, изучение которых должно привести к созданию новых классов лечебных препаратов, в том числе и против вирусных инфекций. РНК вирусов связывается с рибосомами наших клеток и заставляет их переключиться на синтез компонентов вируса, его белков и РНК, причем делается это очень эффективно. Одна и та же последовательнсть нуклеотидов РНК вируса может быть прочитана дважды. Если начать считывание иРНК со сдвигом на один нуклеотид (сдвиг рамки считывания), то получится совсем другая последовательность аминокислот, совсем другой белок с другими свойствами. РНКовые вирусы (в том числе вирус СПИДА, ВИЧ) используют такой механизм для регулирования синтеза своих белков в нужной пропорции. Изучение молекулярных механизмов программированного сдвига рамки считывания в рибосоме неизбежно приведет к созданию соединений, способных нарушать эти процессы и останавливать размножение вирусов. Большинство фармацевтических фирм за рубежом уже организовали исследовательские группы, занимающиеся этой проблемой. Лаборатория Биосинтеза белка ОМРБ ПИЯФ (зав. к.б.н. Катунин В.И.) также занимается изучением этой проблемы и получила в 2009 г. небольшой грант от Президиума РАН для проведения таких исследований. К сожалению, масштабы финансирования недостаточны, и не видно пока перспектив к изменению ситуации. C.В.Кириллов, доктор биол. наук, профессор
|
||||||||||