 |
||
“Мусорная
ДНК“ или длинные некодирующие последовательности
в исследованиях на мышах. Новые перспективы в изучении генома человека. Дешифровка языка майя являлась нетривиальной задачей и стала
возможной только тогда, когда Юрий Кнорозов сделал п На наш взгляд, чтобы понять, что кодирует «мусорная ДНК»,
необходимо принять подобный принцип многокомпонентного статуса генов
и его продуктов. Несмотря на огромные усилия, включая международный
проект ENCODE, на данный момент никому пока не удалось определить роль
большинства длинных некодирующих (нк)РНК (по разным оценкам около 15.000 транскриптов),
как и не удалось установить их возможные биологические функции. Имеются
данные о том, что длинные нкРНК могут регулировать
различные важные процессы жизнедеятельности клетки, такие как изменение
состояния хроматина, ретротранспозиция, регуляция
транскрипции, трансляция, и, что самое главное — хранение информации
о быстром ответе на стресс. В настоящее время наиболее
неясной остается роль нкРНК при ответах на
стрессы окружающей среды, в первую очередь болезненного состояния организма
при низком содержании кислорода - гипоксии.
Нельзя не отметить, что гипоксия и устойчивость к ней играет существенную
роль в развитии многих заболеваний, таких как ишемическая болезнь сердца,
аритмия, рак, диабет II типа и многих других. Недавно мы обнаружили
существенную разницу в уровнях транскрипционной активности различных
нкРНК между двумя линиями мышей, которые были
использованы для изучения ответа генов сердечной мышцы при гипоксии.
В качестве экспериментальной модели нами были выбраны линии мышей CD-1
и C57BL/6J в связи с известными у них физиологическими
различиями в ответ на летальное содержание кислорода (меньше
5%). Мыши C57BL/6J имеют врожденную устойчивость к летальной гипоксии,
в то время как у CD1 мышей это свойство полностью отсутствует. Анализ
данных экспрессионных чипов от компании Agilent
выявил изменения в активности небольшого числа генов (около 100) в мышиной
линии C57BL/6J, тогда как у CD1 изменения были зарегистрированы более
чем в 1000 генах. Данные по экспрессии нкРНК
были противоположными: так, у мышей C57BL/6J изменения активности были
зарегистрированы для большего количества нкРНК,
чем у мышей CD1. То есть, в быстром и комплексном ответе, обеспечивающем
процесс выживания, были задействованы изменения не только генов, но
и экспрессия определенных нкРНК, которые отличались
между двумя линиями мышей не только количеством, но и своим составом.
Особый интерес в нашей работе состоит в выявлении процессов и систем,
в которых участвуют нкРНК, обеспечивающих устойчивость к изменениям окружающей
среды. Способность организма изменять свою деятельность соответственно
характеру и силе внешних воздействий является основой адаптации организма.
При этом следует различать два вида приспособительных изменений: срочные
(неустойчивые) и накопительные (кумулятивные, устойчивые). Возможно,
что часть выделенных нами нкРНК ответственна
за кумулятивные изменения, приобретенные в процессе эволюции и может
иметь двойную функцию, кодируя и белки, и РНК.
Подводя итоги, можно отметить, что сегодня самый масштабный
проект по исследованию генома человека (GWAS) выявил полное отсутствие
достоверных генетических маркеров в кодирующих участках ДНК, прогностически значимых для определения риска сердечно-сосудистых
заболеваний. Важной прикладной целью нашего исследования является установление
связи между распространенными заболеваниями человека и теми последовательностями
«мусорной ДНК», которые были выявлены у мышей, но присутствуют в разных
комбинациях и у человека, что открывает новые перспективы для проекта
«Геном человека». Несомненным преимуществом является то, что мы владеем
информацией не об одной нкРНК, а о некой совокупности
последовательностей, которые, как показал первичный поиск, встречаются
у человека на разных хромосомах и могут быть представлены разным количеством
копий. Все это дает надежду, что наши исследования
помогут в будущем создать полный персональный профиль экспрессии индивидуальных
геномов, что является одной из задач персонализированной медицины будущего. Катерина Фомичева. Компания Jerichon,
Ann Arbor MI, 48105 |
||
Об авторе статьи Екатерина
Викторовна Фомичева начала работать в лаборатории молекулярной генетики
человека ФГБУ «Петербургский институт ядерной физики» (ПИЯФ РАН) с момента
основания лаборатории в 1991 году, после окончания кафедры биохимии
СПбГУ. Лабораторию в те годы возглавлял проф. Евгений Иосифович Шварц,
стоявший у истоков зарождения молекулярной медицины в России. Любимым
направлением его научных интересов, безусловно, была молекулярная кардиология,
и Екатерина Викторовна сразу включилась в исследования, направленные
на выявление предрасположенности к артериальной гипертензии. В 1999
году Фомичева Екатерина защитила кандидатскую диссертацию по теме «Роль
структурных полиморфизмов генов ренин-ангиотензинового
каскада в развитии инфаркта миокарда».
С 2002 года Екатерина работает в США, примкнув к существенной
части нашей лаборатории, работающей за рубежом. Нужно отметить, что
именно Екатерина Фомичева является связующим звеном между теми, кто
уехал и теми, кто продолжает трудиться в стенах ПИЯФ. Не забывая своих
учителей, Екатерина нашла возможность посетить отечественные конференции,
посвященные памяти Е.И.Шварца в 2010 и 2012гг., где представила результаты
своих исследований. Посещая Россию, Екатерина проводит интересные научные
семинары в ПИЯФ. В настоящее время Екатерина Фомичева является известным
специалистом по изучению реакции организма на стресс, вызванной кислородным
голоданием (гипоксией). Нынешнее направление исследований Фомичевой
Е.В. посвящено одной из сложнейших, интереснейших и неразгаданных пока
тем: зачем в геноме человека так много участков ДНК, которые не кодируют
белки (около 98% всего генома)? Как оказалось, в части этой, так называемой,
«мусорной ДНК» зашифрована последовательность некодирующей
РНК (нкРНК), функции которой также остаются мало изученными. Предполагается,
что такая нкРНК может
регулировать работу генома. Настоящие исследования
Екатерины Фомичевой направлены на изучение влияния гипоксии на формирование
таких нкРНК. Радостно видеть успехи коллег, с которыми проведены
замечательные годы научного становления, поисков, достижений, разочарований
и открытий. Ведущий научный сотрудник
лаборатории молекулярной генетики человека ОМРБ ПИЯФ к.б.н.
Пчелина С.Н. |
 редположения
об особенностях дешифровки или, другими словами, подобрал работающий
ключ. Решающим моментом было предположение о том, что одни и те же фонетические
звуки могут быть закодированы различными иероглифами, а также то, что
иероглифы могли представлять как слово, так и слог. Геном человека состоит
из 3.02 млрд. пар оснований, причем кодирующие белки последовательности
составляют по разным оценкам всего лишь 1,2% всего генома. Из-за полного
отсутствия знаний о функциях остальных 98,8 процентов человеческого
генома в
редположения
об особенностях дешифровки или, другими словами, подобрал работающий
ключ. Решающим моментом было предположение о том, что одни и те же фонетические
звуки могут быть закодированы различными иероглифами, а также то, что
иероглифы могли представлять как слово, так и слог. Геном человека состоит
из 3.02 млрд. пар оснований, причем кодирующие белки последовательности
составляют по разным оценкам всего лишь 1,2% всего генома. Из-за полного
отсутствия знаний о функциях остальных 98,8 процентов человеческого
генома в 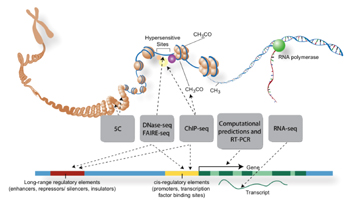 Используя
Используя