| |
В
Петербургском институте ядерной физики прошел конкурс лучших научных
работ 2011 года. Среди исследований, выполненных в отделении молекулярной
и радиационной биофизики, высоко оцененными оказались сразу две работы:
одна, посвященная изучению структуры материала наследственности в клетках
высших организмов, другая – исследование механизма синтеза белков в
рибосомах.
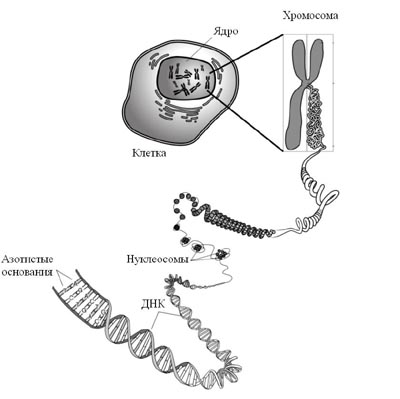 Генетическая информация записана в виде последовательности нуклеотидов
в нитях ДНК, которые с помощью белков уложены в структуры разных размеров,
известных как нуклеосомы (самые маленькие
и видимые только в электронный микроскоп) и хромосомы (самые большие
и видимые в световой микроскоп). Парадокс заключается в том, что при
размерах ядра клетки высших организмов порядка 5 – 20 микрометров, общая
длина находящихся в нем хромосом составляет порядка 2-х метров. Это
означает, что ДНК-белковый комплекс, называемый хроматином, имеет
плотную упаковку. При этом на ДНК должны активно идти процессы репликации
(удвоения), транскрипции (синтеза информационных молекул РНК), репарации
(восстановление поврежденных участков) и др. Как обеспечивается доступность
к такому плотному полимерному клубку и почему нити не перепутываются,
до сих пор остается не понятным. Первый свет на принципы организации
хроматина, обеспечивающей его функционирование, пролила работа, выполненная
сотрудниками лабораторий: биофизики макромолекул под руководством к.
ф.-м. н. В.В. Исаева-Иванова и клеточной биологии (к.б.н.
М.В. Филатов). Они использовали поток нейтронов, рассеиваемых на фиксированных
ядрах, выделенных из клеток высших организмов. При измерении интенсивности
рассеивания под разными углами оказалось возможным, в отличие от других
методов, получить одновременно информацию как
о самых маленьких структурах хроматина, так и о ядре в целом. Обработка
экспериментальных результатов подтвердила гипотезу о фрактальной природе
хроматина. Фрактальные структуры (приближенно самоподобные
при разном масштабе) широко встречаются в природе, но применительно
к хроматину это означает отсутствие самопересечений (узелков) и доступность
генетического материала для ферментативных комплексов любого размера.
Обнаруженные сотрудниками две фрактальные размерности хроматина позволят
объяснить процессы диффузии макромолекул в областях локализации хромосом.
Следует заметить, что эта работа была выполнена с
использованием пучков нейтронов реактора в г. Дубна Московской обл.
и реактора в г. Юлих в Германии. С
запуском реактора ПИК в Гатчине будет получена
рекордная плотность пучка нейтронов, которая позволит ускорить многие
исследования, в том числе сложных биологических структур. Генетическая информация записана в виде последовательности нуклеотидов
в нитях ДНК, которые с помощью белков уложены в структуры разных размеров,
известных как нуклеосомы (самые маленькие
и видимые только в электронный микроскоп) и хромосомы (самые большие
и видимые в световой микроскоп). Парадокс заключается в том, что при
размерах ядра клетки высших организмов порядка 5 – 20 микрометров, общая
длина находящихся в нем хромосом составляет порядка 2-х метров. Это
означает, что ДНК-белковый комплекс, называемый хроматином, имеет
плотную упаковку. При этом на ДНК должны активно идти процессы репликации
(удвоения), транскрипции (синтеза информационных молекул РНК), репарации
(восстановление поврежденных участков) и др. Как обеспечивается доступность
к такому плотному полимерному клубку и почему нити не перепутываются,
до сих пор остается не понятным. Первый свет на принципы организации
хроматина, обеспечивающей его функционирование, пролила работа, выполненная
сотрудниками лабораторий: биофизики макромолекул под руководством к.
ф.-м. н. В.В. Исаева-Иванова и клеточной биологии (к.б.н.
М.В. Филатов). Они использовали поток нейтронов, рассеиваемых на фиксированных
ядрах, выделенных из клеток высших организмов. При измерении интенсивности
рассеивания под разными углами оказалось возможным, в отличие от других
методов, получить одновременно информацию как
о самых маленьких структурах хроматина, так и о ядре в целом. Обработка
экспериментальных результатов подтвердила гипотезу о фрактальной природе
хроматина. Фрактальные структуры (приближенно самоподобные
при разном масштабе) широко встречаются в природе, но применительно
к хроматину это означает отсутствие самопересечений (узелков) и доступность
генетического материала для ферментативных комплексов любого размера.
Обнаруженные сотрудниками две фрактальные размерности хроматина позволят
объяснить процессы диффузии макромолекул в областях локализации хромосом.
Следует заметить, что эта работа была выполнена с
использованием пучков нейтронов реактора в г. Дубна Московской обл.
и реактора в г. Юлих в Германии. С
запуском реактора ПИК в Гатчине будет получена
рекордная плотность пучка нейтронов, которая позволит ускорить многие
исследования, в том числе сложных биологических структур.
|
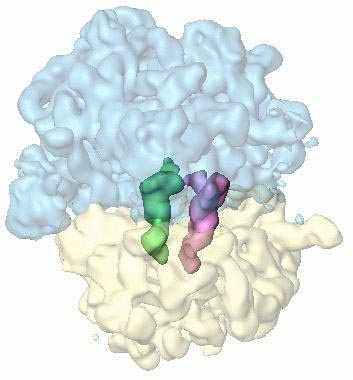
| Рибосома с двумя молекулами тРНК в центре |
Другая
работа выполнена тоже с применением сложного современного метода – электронной криомикроскопии. Исследования
структуры и функции рибосом - клеточных фабрик по синтезу белков в 2009 г. были удостоены Нобелевской
премии. Казалось бы, невозможно теперь получить новые яркие результаты.
Однако сотрудники лаборатории биосинтеза белка под руководством к.б.н. В.И. Катунина сумели полностью
реализовать свой опыт по исследованию термодинамики синтеза белка и
эффективно использовать экспериментальные возможности своих немецких
коллег в г. Геттинген. Они сумели замедлить скоротечный процесс биосинтеза
белка, обратив реакцию вспять. Быстро заморозив комплексы рибосом с
матричными и транспортными РНК, они получили функционировавшие рибосомы,
застывшие каждая на своей стадии сложной многоступенчатой реакции, связанной
с перемещением РНК внутри рибосомы и движением субъединиц относительно
друг друга. Обычно такая гетерогенность образцов приводила к низкому разрешению электронной
микроскопии. Авторы сумели обратить этот недостаток в достоинство.
Они проанализировали 2 миллиона рибосом
и разделили их по кластерам, характерным для каждой стадии реакции.
Это значительно улучшило разрешение усредненных изображений и позволило
в мельчайших деталях увидеть все траектории движения транспортных РНК
внутри рибосом
(Рисунок), http://biod.pnpi.spb.ru/ribosome.
Видеоролик, составленный из изображений последовательных реакций присоединения
к растущей цепи белка аминокислот, доставляемых тРНК
в рибосому, поражает красотой и отточенностью механизма, который природа совершенствовала
на протяжении миллиардов лет.
Зав. лабораторией молекулярной
генетики ПИЯФ д.б.н. В.Н. Вербенко.
|
|

 Генетическая информация
Генетическая информация